INTRODUÇÃO O angiofibroma nasofaríngeo juvenil (ANJ) é uma neoplasia rara, de histologia benigna, que afeta quase que exclusivamente indivíduos adolescentes do sexo masculino. Corresponde a 0.05% de todos os tumores de cabeça e pescoço, sendo, porém o tumor benigno mais comum da nasofaringe (1,2). O ANJ é um tumor altamente vascularizado e seu sítio de origem provável é na margem superior do forame esfenopalatino (1,3). Embora classificado como benigno, o ANJ é um tumor localmente agressivo de alta morbimortalidade, e está associado a conseqüências graves, como extensão intracraniana em 10% a 36% dos casos (4). Os conhecimentos básicos mais sólidos a respeito do ANJ dizem respeito à sua histologia.
O ANJ é um tumor composto de fibrócitos estrelados envoltos por um estroma variável de tecido conectivo. O tumor possui vasos de parede fina semelhantes a linfáticos que são um achado típico obrigatório (1). Classicamente, o ANJ pode se apresentar com aspecto semelhante ao tecido erétil; ao de um hemangioma cavernoso com estroma fibroso; ou ao de uma fibromatose (1). As porções centrais do tumor são mais fibrosas, com menor número de vasos que se fusionam formando vasos mais dilatados. Essas porções centrais têm a atividade de crescimento em estado de relativa latência (5,6). Na periferia do ANJ são comumente encontradas ulcerações e a vascularização é mais intensa, sendo pobre em estroma fibroso. Essas regiões periféricas representam à área de proliferação ativa do tumor, e os vasos se assemelham aos de tecido de granulação (1,5). Tal disposição tecidual sugere um gradiente de maturação do centro para a periferia (5,6).
O tamanho do ANJ se correlaciona com seu conteúdo histológico, ocorrendo uma evolução natural de um tecido mais vascular para um tecido mais fibroso. Os tumores maiores têm menor número de vasos e células, maior componente fibroso e nível de maturação tecidual. Por outro lado, os tumores menores têm uma porção central com vasos abundantes em proliferação e hiperplasia de capilares (6). Os componentes vasculares e fibrosos do ANJ apresentam uma maturação sincrônica, com alteração regular e progressiva dos vasos sanguíneos, sugerindo que o tumor tem um crescimento limitado pela diminuição da vascularização (5), com possível involução tendo sido inclusive relatada (7). As fibras noradrenérgicas se localizam nas porções periféricas do tumor o que pode indicar que durante a excisão cirúrgica, manter o plano de dissecção afastado de seu parênquima, pode diminuir o sangramento pela manutenção da inervação vasoconstrictora local (8).
A histologia do ANJ foi bem relacionada à duração de sintomas na apresentação da doença. Obstrução nasal, presença da massa tumoral e deformidade facial foram correlacionadas diretamente à maturação tecidual, e inversamente à celularidade (9). Em relação à epistaxe, sua duração mostrou relação direta com a presença de vasos sem camada muscular sugerindo que a característica hemorrágica do ANJ é mais relacionada à fragilidade de seus vasos do que ao número destes (9). Além disso, observou-se que com o desenvolvimento do componente fibroso, a tendência a sangramento diminui (9).
Classicamente a histologia do ANJ foi analisada tomando como base apenas o componente vascular e estromal. WENDLER et al. caracterizaram o componente inflamatório do tumor (10). Um número surpreendente de mastócitos foi encontrado no ANJ (14,6% das células), além de linfócitos, representando os tipos celulares predominantes (10).
A estrutura do ANJ está bem caracterizada. Porém, há uma escassez de estudos que exploram seus determinantes genéticos e imunopatogênicos, o que seria de grande valia para o melhor entendimento da etiologia e patogenia desse tumor. A presente revisão pretende explorar sucintamente os aspectos genéticos e moleculares do ANJ, ressaltando aspectos fisiopatológicos que poderão contribuir para futuras abordagens terapêuticas.
MÉTODO Foi realizado um levantamento bibliográfico, sem data limite, utilizando-se livros, periódicos e estudos acessados eletronicamente em base de dados PUBMED e LILACS. Todas as referências pertinentes ao tema encontradas apresentaram data de publicação entre 1959 e 2007. Foram escolhidos para a pesquisa os termos: "Juvenile nasopharyngeal angiofibroma", "Juvenile nasoangiofibroma", "Genetics", " Morphology", "Growth factors", "Sexual hormones". "Angiofibroma nasofaríngeo juvenil", "Nasoangiofibroma juvenil", "Genética", "Morfologia", "Fatores de crescimento" e "Hormônios sexuais".
Bendito {seja} o Deus e Pai de nosso Senhor Jesus Cristo, que, segundo a sua grande misericórdia, nos gerou de novo para uma viva esperança, pela ressurreição de Jesus Cristo dentre os mortos, para uma herança incorruptível, incontaminável e que se não pode murchar, guardada nos céus para vós que, mediante a fé, estais guardados na virtude de Deus, para a salvação já prestes para se revelar no último tempo, em que vós grandemente vos alegrais, ainda que agora importa, sendo necessário, que estejais por um pouco contristados com várias tentações, para que a prova da vossa fé, muito mais preciosa do que o ouro que perece e é provado pelo fogo, se ache em louvor, e honra, e glória na revelação de Jesus Cristo; ao qual, não o havendo visto, amais; no qual, não o vendo agora, mas crendo, vos alegrais com gozo inefável e glorioso, alcançando o fim da vossa fé, a salvação da alma.
RESULTADOS
Fatores genéticos Os determinantes genéticos envolvidos na patogênese do ANJ permanecem desconhecidos, e importantes características como predileção pelo sexo masculino (Figura 1A) e comportamento agressivo (Figura 1B e 1C) não possuem ainda razão genética completamente definida. Entretanto, a existência de uma seletividade em relação ao sexo, a regressão espontânea em alguns poucos pacien tes e a transformação maligna em raríssimos casos sugerem juntos a existência de complexos mecanismos genéticos em sua patogênese (11).
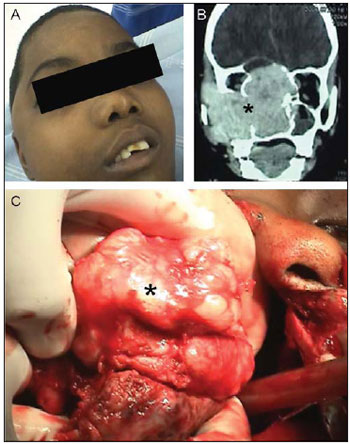
Figura 1. Aspectos topográficos e cirúrgicos do Angiofibroma nasofaríngeo. - (A) Deforminade facial em jovem portador do tumor no pré-operatório. (B) Tomografia computadorizada: Corte coronal evidenciando invasão intracraniana. (C) Foto intraoperatória mostrando o aspecto macroscópico do tumor. O tumor está evidenciado nas fotos por asterixos (*).
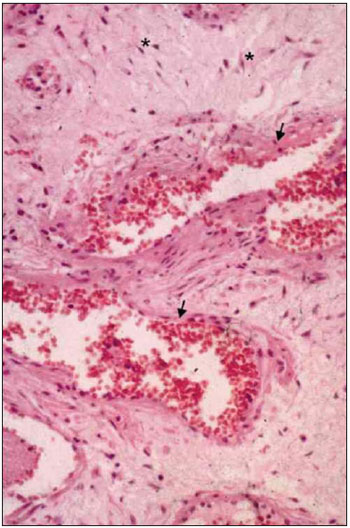
Figura 2. Histologia do Angiofibroma nasofaríngeo. - Os aspectos clássicos do tumor revelam fibrócitos estrelados (*) em estroma de tecido conjuntivo, além de vasos de parede fina (setas).
O gene da glutationa-S-transferase M1 (GSTM1), expresso constitutivamente nas células humanas e que apresenta propriedades citoprotetoras anti-oxidantes, tem a sua perda de expressão associada ao fumo e ao desenvolvimento de malignidades no trato aerodigestivo superior. GAUTHAM e colaboradores investigaram alterações do GSTM1 no contexto de pacientes não fumantes com ANJ. Os resultados mostraram que três dentre oito pacientes não expressaram o GSTM1, representando 37,5% de ausência desse gene (12).
O fator de crescimento semelhante à insulina II (IGFII) é uma proteína de ação estimulatória sobre o crescimento, envolvida no desenvolvimento fetal. O IGFII foi detectado com expressão aumentada em 53% dos tecidos tumorais de pacientes com ANJ. Esse achado sugeriu que o gene do IGFII pode estar envolvido na obscura gênese tumoral do ANJ (13). A expressão do gene IGFII é um dos alvos do recém descoberto imprinting genômico. O imprinting genômico é um processo de inativação seletiva de alelos que resulta em silenciamento transcricional. O gene do IGFII sofre imprinting materno, ou seja, expressa normalmente apenas o alelo paterno (14). A perda do imprinting leva a expressão bialélica anormal, que tem sido associada à perda de controle do ciclo celular. Em um estudo investigando perdas de imprinting no gene IGFII e no H19, um gene também relacionado à patogênese tumoral, foi relatada expressão bialélica do IGFII em 50% dos ANJ estudados. Além disso, foi detectada superexpressão de IGFII e H19 em níveis importantes (15).
Estudos pioneiros recentes, utilizando a técnica de hibridização genômica comparativa (CGH), demonstraram numerosas anormalidades cromossômicas no ANJ. Ganhos e perdas foram detectados em cromossomos autossômicos e, com maior freqüência, em cromossomos sexuais (16,17,18).
A quantidade de alterações em número de cópias é superior a de diversos tumores malignos, apesar do ANJ ser visto histologicamente como um tumor benigno. Perdas na estabilidade genômica estão possivelmente relacionadas a esses achados, e existem diversas regiões consenso de anormalidades cromossômicas a serem avaliadas. Amplificações detectadas nos genes AURKA e MDM2, ambos relacionados à instabilidade genômica, foram consistentes com as alterações cromossômicas encontradas (18).
A combinação da perda do cromossomo Y com o ganho do X é uma associação encontrada de forma significante. Como cada cromossomo X expressa quase que invariavelmente um gene para o receptor de androgênio (AR), o ganho de cromossomo X resulta assim em ganho do gene AR (17). Esse ganho pode então explicar a evidência histológica documentada no ANJ, de expressão do AR em 75% dos casos (19). O encontro de duas cópias do gene AR em núcleos de células do ANJ, juntamente com a presença de AR, reafirma a importância da estimulação androgênica na patogênese desse tumor.
Um outro estudo genético recente utilizando a técnica de CGH demonstra que no ANJ, as alterações genômicas são caracterizadas em sua maioria por ganhos gênicos, e não por perdas. Isso é um possível indicativo de que a ativação de oncogenes tem maior importância do que a inativação de genes supressores de tumor (20). Especificamente, genes da via Rab e proteínas de ligação ao retinoblastoma, dentre outros, foram encontrados em diversas das regiões amplificadas, e ambos têm sua superexpressão associada a outros tumores. Não se sabe, porém a relevância desses achados. Um aspecto também importante é a constatação de diferenças nas alterações genéticas entre tumores primários e recorrentes. Essas diferenças indicam que esses casos de tumores recorrentes são verdadeiramente tumores novos, pois seria esperado um padrão de aberrações cromossômicas semelhantes, caso os tumores recorrentes fossem originários de tumores residuais primários (20).
Tem sido sugerida uma associação causal entre o ANJ e a síndrome da polipose adenomatosa familiar (PAF) (21,22). Essa síndrome é uma condição autossômica dominante caracterizada por múltiplos adenomas no trato gastrintestinal, tendência ao desenvolvimento de adenocarcinomas, e manifestações extra-intestinais. (23) Acreditase que o ANJ seja uma das manifestações extracolônicas da PAF, com o ANJ ocorrendo em uma freqüência até 25 vezes maior em pacientes com essa síndrome (21).
A PAF resulta de mutações de linhagem germinativa no gene APC (
Adenomatous Polyposis Coli), que se localiza no cromossomo 5q. O produto desse gene APC, uma proteína supressora de tumor, é responsável pela infra-regulação dos níveis de β-catenina, dentre outros fatores. Em um paciente com associação de PAF e ANJ, foram descritas mutações em genes APC, principalmente nas células estromais do tumor. Esses dados reforçam a suspeita de que o ANJ seja uma das muitas manifestações da PAF (24). Buscando explicações para a patogênese do ANJ também na via APC/β-catenina, foi feita uma análise de mutações envolvendo esses genes e seus produtos, no contexto desse tumor. Acúmulo intranuclear de β-catenina foi detectado, na maior parte dos ANJ estudados. Apesar de não terem sido encontradas mutações no gene APC, mutações de alta freqüência no gene da β-catenina foram encontradas na maioria dos tumores (25). Algumas dessas mutações sabidamente interferem na degradação da β-catenina, podendo portanto estarem envolvidas no seu acúmulo intranuclear (25,26,27). A β-catenina é uma proteína sinalizadora que interage com a via de sinalização androgênica, ligando-se seletivamente ao AR e sendo translocada para o núcleo como parte desse complexo. Essa translocação para o núcleo depende da presença de 5α-diidrotestosterona, e é função específica do AR. A β-catenina age ainda como um coativador, modulando a transcrição gênica de genes AR-dependentes.
O acúmulo intranuclear de β-catenina, por ser encontrado apenas nas células estromais e não em células endoteliais ou de músculo liso, sugere que o elemento neoplásico chave desse tumor é o componente estromal. Além disso, nesse mesmo estudo, a comparação das alterações genéticas em tumores primários e recorrentes revelou mutações idênticas, o que vai de encontro a dados citados anteriormente. Esses achados corroboram a definição do ANJ como uma neoplasia verdadeira (25,26).
O p53 é um gene supressor de tumor e o Her-2/neu um oncogene, que se localizam no cromossomo 17, e que também tiveram o seu papel no ANJ investigado. Ambos têm alterações em sua expressão, como por exemplo, mutações no gene p53 e superexpressão de Her-2/neu, relacionada a diversos tumores. O p53, também chamado de "policial molecular" pelas suas ações de resposta à lesão do DNA, sofreu perdas em 5 dentre 7 ANJ analisados, e não foram observadas amplificações em nenhum caso (28). O oncogene Her-2/neu, que se mostrou exercendo estimulação independente sobre o AR no contexto do câncer de próstata, teve perdas detectadas em quantidades similares, sem amplificações. Porém, essas perdas não foram associadas de forma importante a diminuições nos níveis de mRNA para p53 ou Her-2/neu, e, pelo contrário, foi encontrado aumento no níveis de mRNA para p53 (28). É possível que essas incongruências sejam apenas aparentes, pelo fato de que interferências na via da p53 pela β-catenina são conhecidas. Dada a importância da β-catenina no ANJ, as perdas do gene p53 encontradas podem indicar perda de sua função protetora no contexto desse tumor.
Outro gene que tem sido investigado no ANJ é o prooncogene MYC, que tem desordens em sua expressão como causa de alteração na proliferação, crescimento e metabolismo celular, estando associado a uma ampla gama de malignidades. Foi observada heterogeneidade em ANJ avançados, associada a aumento da expressão de C-MYC. O aumento na expressão foi quantificado por níveis aumentados de mRNA e proteína desse protooncogene (29). A regulação para cima de C-MYC pode portanto, estar ligada aos fenótipos de crescimento mais agressivos no ANJ. Isso é reafirmado pelo fato de que interações entre C-MYC, β-catenina e AR foram descritas, no contexto do crescimento neoplásico na próstata. A β-catenina participa ativamente da regulação do protooncogene MYC, e o AR pode se ligar a um elemento responsivo em C-MYC. Logo, a desregulação de C-MYC no ANJ é mais um indício a favor da dependência da estimulação androgênica que esse tumor possui.
Mutações em genes da família ras, Ki-ras e Ha-ras, já associadas ao tabagismo e várias neoplasias malignas, não têm sido relacionadas à patogênese do ANJ (30), nem à de outro tumores de cabeça e pescoço (31).
Fatores moleculares Pouco é conhecido sobre os fatores de crescimento envolvidos na patogênese do ANJ, e seus mecanismos de iniciação e progressão não são bem conhecidos. Suas características únicas porém, indicam que os fatores crescimento envolvidos fazem parte de uma complexa rede de interações, que inclui citocinas, hormônios, e outros mediadores.
O fator β transformador do crescimento (TGF-β) é um fator de crescimento polipeptídeo produzido por muitos tipos celulares, como fibroblastos, células endoteliais e macrófagos. Seu papel na patogênese neoplásica é complexa, exercendo funções de regulação do ciclo celular, cicatrização e indução da angiogênese. A via de sinalização do TGF-β está associada a aumento da agressividade em diversos tipos de tumor (32). Em um estudo utilizando imunohistoquímica, foi demonstrada a presença de TGF-β1 ativado no núcleo e no citoplasma de células estromais, e no endotélio de capilares em 100% dentre 19 ANJ estudados (33).
Como já dito anteriormente, um fator de crescimento que parece envolvido na patogênese do ANJ é o IGFII, pela sua significante superexpressão nesse tumor, juntamente com outros fatores como o fator de crescimento derivado de plaquetas (PDGF), sem entretanto o mesmo nível de expressão (13). Em contraste, a expressão de IGF- 1R, um receptor do IGF associado à tumorigênese, não foi detectada no ANJ, sendo assim necessário novos estudos em busca de uma melhor compreensão do verdadeiro papel do IGF no ANJ (26).
Foi detectada por imunohistoquímica uma alta expressão de c-Kit e NGF (fator de crescimento do nervo) em células estromais do ANJ, comparado a tecidos de pólipos nasais (26) Altos níveis de c-Kit (CD117), uma proteína com ação tirosina quinase da família dos receptores do fator de crescimento derivado de plaquetas (PDGFR), já foram relacionados a outros tumores. Os altos níveis de c-Kit encontrados no ANJ tornam essa proteína um possível alvo terapêutico de inibidores específicos da tirosina quinase. O outro fator de crescimento encontrado de forma importante, o NGF, parece exercer influências na angiogênese, e na diferenciação e função mastocitária, o que ganha relevância visto a já relatada grande quantidade dessas células no tumor (10).
O fator de crescimento de fibroblasto básico (FGFb) é outro fator mitogênico que foi detectado no ANJ, tendo sido associado à sua patogênese (34). Esse fator tem conhecida ação estimulatória sobre o crescimento de células endoteliais, musculares e fibroblastos, sendo implicado nos processos de remodelamento tecidual, apoptose, cicatrização, angiogênese, e no crescimento tumoral. O ANJ, como qualquer outro tumor sólido, depende do crescimento de vasos que ofereçam aporte à sua proliferação e crescimento, o que justifica a busca por fatores de crescimento proangiogênicos em sua patogênese.
A alta vascularização do ANJ, confirmada por imunohistoquímica, está diretamente correlacionada ao fator de crescimento endotelial vascular (VEGF). O VEGF é expresso principalmente nas células estromais e vasos do ANJ, e está associado às regiões no tumor de proliferação e alta densidade vascular (35). Nesse estudo porém, não foi encontrada correlação entre tamanho do tumor e sua vascularização. Assim, a expressão do VEGF no ANJ está ligada à maior densidade de vasos, mas não necessariamente à sua agressividade (35). A maior densidade de vasos no ANJ está ainda relacionada a níveis aumentados de outros fatores de crescimento, como o bFGF e TGF- β, e também à expressão de receptores do VEGF. Esses achados podem ajudar a explicar as características peculiares de crescimento estromal excessivo e alta densidade de vasos do ANJ. Além disso, a inibição da liberação e função desses fatores de crescimento é um possível alvo terapêutico para certos casos de ANJ (36). Em uma outra grande série, vinte quatro casos dentre vinte e sete tiveram marcação significativa de VEGF, enquanto que a marcação de TGF-beta foi encontrada em quatorze casos, podendo ambos exercerem um papel na patogênese tumoral pela promoção da angiogênese e proliferação celular (37).
Outra constatação importante do estudo de SCHUON et al. é que a expressão de Hif-1α, uma molécula relacionada à via do VEGF e ao estado de hipóxia, foi demonstrada em células estromais e vasos do ANJ (36). Esse marcador de hipóxia localizado pode indicar a presença de vasos não funcionais. Desse modo a alta densidade de vasos no ANJ não significa necessariamente uma devida oferta tecidual de oxigênio (36).
A característica manifestação do ANJ em indivíduos do sexo masculino e jovem, em um período de grande influência hormonal, sempre levantou suspeita a cerca do papel dos hormônios sexuais em sua patogênese. Desde que uma anormalidade no eixo hormonal hipotalâmico foi proposta por SCHIF (38), como teoria da patogênese do ANJ, a expressão de receptores hormonais no ANJ já foi alvo de diversos estudos. FARAG e colaboradores demonstraram receptores androgênicos específicos no ANJ com maior afinidade pela diidrotestosterona que pela testosterona (39). No ANJ, agentes anti-androgênicos como a flutamida podem diminuir a taxa de crescimento do ANJ
in vitro (40), e além do receptor androgênico, outros receptores esteróides já foram detectados (39,41). Entretanto, não são encontradas alterações nos níveis séricos de hormônios sexuais (39,42) nem alterações na maturidade sexual de pacientes com ANJ. Mais recentemente, a definição do tumor como dependente de androgênios tem sido questionada (43), o que pode ajudar a explicar os resultados inconclusivos e a imprevisibilidade do tratamento com anti-androgênicos (44,45). Apesar da controvérsia existente, a via de estimulação hormonal permanece sendo um potencial alvo terapêutico do ANJ. Novos ensaios clínicos são necessários para que seja definida a real relevância dessa abordagem (46).
DISCUSSÃO O extenso conhecimento sobre a patologia do ANJ começou a ser estabelecido há décadas, com a descrição dos achados morfológicos clássicos. A histologia e microestrutura do tumor foram mais recentemente esclarecidas (ver aspectos gerais da microscopia na Figura 2). Apesar dos avanços no campo da descrição anátomopatológica, existem poucos estudos a cerca dos aspectos moleculares e genéticos do ANJ. A maioria das investigações sobre a genética do ANJ leva a resultados inconclusivos ou que adicionam pouco ao conhecimento existente sobre o tumor. O acúmulo nuclear de β-catenina, um coativador do receptor androgênico, pode ser responsável pela sua quase exclusiva seletividade ao sexo masculino. Essa explicação é consistente com os achados de níveis séricos normais de hormônios em pacientes com ANJ.
Para o crescimento e metástase de tumores sólidos, fatores de crescimento angiogênicos são essenciais. O desenvolvimento do ANJ parece ser influenciado por VEGF, TGF-β1 e IGFII, porém o real estímulo à produção desses mediadores ainda não foi claramente definido. As possíveis conseqüências terapêuticas desses achados são também desconhecidas.
Nenhuma teoria sobre a patogênese do ANJ pôde explicar se evento inicial do seu desenvolvimento ocorre no endotélio ou no estroma tumoral. Assim, existem ainda desafios no entendimento da imunopatogênese do ANJ, como o estudo fenotípico da resposta imune anti-tumoral
in situ. É necessário o estudo de alterações genéticas nos tumores primários, através de técnicas "high-throughput" com análise de expressão em tempo real de grupamentos de genes correlatos, para a detecção de possíveis preditores de risco aumentado de recorrência. Esses preditores poderão ajudar no seguimento dos pacientes, após a remoção cirúrgica.
CONSIDERAÇÕES FINAISSão diversas as controvérsias a respeito da patogênese do ANJ. Porém, ainda que parcialmente, fatores genéticos e moleculares podem explicar a característica agressiva e angiogênica do tumor, além de sua seletividade em relação ao sexo.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Batsakis JG. Tumors of the head and neck: clinical and pathological considerations. 2a ed. Baltimore, MD: Williams & Wilkins; 1979, pp. 296-300.
2. Biswas D, Saha S, Bera SP. Relative distribution of the tumours of ear, nose and throat in the paediatric patients. Int J Pediatr Otorhinolaryngol. 2007, 71(5):801-5.
3. Beham A, Beham-Schmid C, Regauer S, Auböck L, Stammberger H. Nasopharyngeal angiofibroma: true neoplasm or vascular malformation? Adv Anat Pathol. 2000, 7:36-46.
4. Cummings C. Otolaryngology - Head and neck surgery. 4ª ed. 2005, pp. 1669-1672.
5. Liang J, Yi Z, Lianq P. The nature of juvenile nasopharyngeal angiofibroma. Otolaryngol Head Neck Surg. 2000, 123:475-81.
6. Sennes LU, Sanchez TG, Bernardi FC, Saldiva PH. Tissue maturation during the growth of juvenile nasopharyngeal angiofibroma. Ann Otol Rhinol Laryngol. 2004, 113(1):34-38.
7. Weprin LS, Seimens PT. Spontaneuos regression of juvenile nasopharyngeal angiofibroma. Arch Otolaryngol Head and Neck Surg. 1991, 117:796-799.
8. Wang HW, Su WY, Wang JY. Noradrenergic innervation of juvenile nasopharyngeal angiofibroma. Eur Arch Otorhinolaryngol. 1994, 251: 123-126.
9. Sennes LU, Fortes FSG, Butugan O, Saldiva PH, Bernardi FC. Tissue maturation correlating to clinical manifestations in juvenile angiofibroma. Ann Otol, Rhinol Laryngol. 2005, 114(9):705-708.
10. Wendler O, Schäfer R, Schick B. Mast cells and T-lymphocytes in juvenile angiofibromas. Eur Arch Otorhinolaryngol. 2007, 264:769-775.
11. Makek MS, Fisch U, Andrews JC. Malignant transformation of a nasopharyngeal angiofibroma. Laryngoscope. 1989, 99:1088-1092.
12. Gautham K, Ogale SB, Shraddha RU, Ajay D. Expression of GSTM1 in angiofibromas. J Laryngol Otol. 2002, 116:352-354.
13. Nagai MA, Butugan O, Logullo A, Brentani MM. Expression of growth factors, protooncogenes and p53 in nasopharyngeal angiofibromas. Laryngoscope. 1996, 106(2):190-195.
14. Falls JG, Pulford DJ, Wylie AA, Jirtle RL. Genomic imprinting: implications for human disease. Am J Pathol. 1999, 154(3):635-647.
15. Coutinho-Camillo M, Brentani MM, Butugan O, Torloni H, Nagai MA. Relaxation of imprinting of IGFII gene in juvenile nasopharyngeal angiofibromas. Diagn Mol Pathol. 2003, 12:57-62.
16. Schick B, Brunner C, Praetorius M, Plinkert PK, Urbschat S. First evidence of genetic imbalances in angiofibromas. Laryngoscope. 2002, 112(2):397-401.
17. Schick B, Rippel C, Brunner C, Jung V, Plinkert PK, Urbschat S. Numerical sex chromosome aberrations in juvenile angiofibromas: genetic evidence for an androgen-dependent tumor? Oncol Rep. 2003, 10(5):1251-1255.
18. Schick B, Wemmert S, Bechtel U, Nicolai P, Hofmann T, Golabek W et al. Comprehensive genomic analysis identifies MDM2 and AURKA as novel amplified genes in juvenile angiofibromas. Head Neck. 2007, 29:479-487.
19. Hwang HC, Mills SE, Patterson K, Gown AM. Expression of androgen receptors in nasopharyngeal angiofibroma: an immunohistochemical study of 24 cases. Mod Pathol. 1998, 11:1122-1126.
20. Heinrich U, Brieger J, Gosepath J, Wierzbicka M, Sokolov M, Roth Y. Frequent chromosomal gains in recurrent juvenile nasopharyngeal angiofibroma. Cancer Genet Cytogenet. 2007, 175:138-143.
21. Giardiello FM, Hamilton SR, Krush AJ, Offerhaus JA, Booker SV, Petersen GM. Nasopharyngeal angiofibroma in patients with familial adenomatous polyposis. Gastroenterology. 1993, 105(5):1550-1552.
22. Ferouz AS, Mohr RM, Paul P. Juvenile nasopharyngeal angiofibroma and familial adenomatous polyposis: an association? Otol Head Neck Surg. 1995, 113:435-439.
23. Gardner EJ. Follow-up study of a family group exhibiting dominant inheritance for a syndrome including intestinal polyps, osteomas, fibromas, and epidermal cysts. Am J Hum Genet. 1962, 14:376-390.
24. Curia M C, G Aceto, S Veschi, R Valanzano, L De Lellis. Genetic evidence that juvenile nasopharyngeal angiofibroma is an integral FAP tumour. Gut. 2005, 54:1045-1050.
25. Abraham SC, Montgomery EA, Giardiello FM, Wu TT. Frequent b-catenin mutations in juvenile nasopharyngeal angiofibromas. Am J Pathol. 2001, 158:1073-1078.
26. Zhang PJ, Weber R, Liang HH, Pasha TL, LiVolsi VA. Growth factors and receptors in juvenile nasopharyngeal angiofibroma and nasal polyps: an immunohistological study. Arch Pathol Lab Med. 2003, 127:1480-1484.
27. Rippel C, Plinkert PK, Schick B. Expression of members of the cadherin-/catenin-protein family in juvenile angiofibromas. Laryngo Rhino Otol. 2003, 82:353-357.
28. Schick B, Veldung B, Wemmert S, Jung V, Montenarh M, Meese E, et al. p53 and Her-2/neu in juvenile angiofibromas. Oncology reports. 2005, 13:453-457.
29. Schick B, Wemmert S, Jung V, Steudel W-I, Montenarh M, Urbschat S. Genetic heterogeneity of the MYC oncogene in advanced juvenile angiofibromas. Cancer Genet Cytogenet. 2006, 164:25-31.
30. Coutinho CM, Bassini AS, Gutierrez LG, Butugan O, Kowalski LP, Brentani MM, et al. Genetic alterations in Kiras and Ha-ras genes in juvenile nasopharyngeal angiofibromas and head and neck cancer. Sao Paulo Med J. 1999, 117:113-120.
31. Yarbrough WG, Shores C, Witsel DL, Weinsler MC, Fidler ME, Gilmer TM. Ras mutations and expression in head and neck squamous cell carcinomas. Laryngoscope. 1994, 104(11):1337-1347.
32. Kaklamani VG, Pasche B. Role of TGF-beta in cancer and the potential for therapy and prevention. Expert Rev Anticancer Ther. 2004, 4(4):649-61.
33. Dillard DG, Cohen C, Muller S, Del Gaudio J, Reichman O, Parrish B, et al. Immunolocalization of activated transforming growth factor beta 1 in juvenile nasopharyngeal angiofibroma. Arch Otolaryngol Head Neck Surg. 2000, 126:723-725.
34. Schiff M, Gonzalez AM, Ong M, Baird A. Juvenile nasopharyngeal angiofibroma contain a angiogenic growth factor: basic FGF. Laryngoscope. 1992, 102(8):940-945.
35. Brieger J, Wierzbicka M, Sokolov M, Roth Y, Szyfter W, Mann WJ. Vessel density, proliferation, and immunol immunolocalization of vascular endothelial growth factor in juvenile nasopharyngeal angiofbromas. Arch Otolaryngol Head Neck Surg. 2004, 130(6):727-731.
36. Schuon R, Brieger J, Heinrich Ulf R, Roth Y, Szyfter W, Mann Wj. Immunohistochemical analysis of growth mechanisms in juvenile nasopharyngeal angiofibroma. Eur Arch Otorhinolaryngol. 2007, 264:389-394.
37. Saylam G, Yucel OT, Sungur A, Onerci M. Proliferation, angiogenesis and hormonal markers in juvenile nasopharyngeal angiofibroma. Int J Pediatr Otorhinolaryngol. 2006, 70:227-234.
38. Schif M. Juvenile nasopharyngeal angiofibroma: a theory of pathogenesis. Laryngoscope. 1959, 84:2181-2194.
39. Farag MM, Ghanimah SE, Ragaie A, Saleem TH. Hormonal receptors in juvenile nasopharyngeal angiofibroma. Laryngoscope. 1987, 97(2):208-11.
40. Hagen R, Romalo G, Schwab B, Hoppe F, Schweikert HU. Juvenile nasopharyngeal angiofibroma: androgen receptors and their significance for tumor growth. Laryngoscope. 1994, 104(9):1125-1129.
41. Brentani MM, Butugan O, Oshima CT, Torloni H, Paiva LJ. Multiple steroid receptors in nasopharyngeal angiofibromas. Laryngoscope. 1989, 99(4):398-401.
42. Johns ME, MacLeod RM, Cantrell RW. Estrogen receptors in nasopharyngeal angiofibromas. Laryngoscope. 1980, 90:628-634.
43. Gatalica Z. Immunohistochemical analysis of steroid hormone receptors in nasopharyngeal angiofibromas. Cancer Lett. 1998, 127:89-93.
44. Gates GA, Rice DH, Koopmann CF Jr, Schuller DE. Flutamide-induced regression of angiofibroma. Laryngoscope. 1992, 102(6):641-644.
45. Labra A, Chavolla-Magana R, Lopez-Ugalde A, Alanis-Calderon J, Huerta-Delgado A. Flutamide as a preoperative treatment in juvenile angiofibroma (JA) with intracranial invasion: report of 7 cases. Otolaryngol Head Neck Surg. 2004, 130(4):466-469.
46. Montag AG, Tretiakova M, Richardson M. Steroid hormone receptor expression in nasopharyngeal angiofibromas. Consistent expression of estrogen receptor beta. Am J Clin Pathol. 2006, 125(6):832-7.
1. Doutor em Otorrinolaringologia pela FMUSP. Chefe do Serviço de Otorrinolaringologia Santa Casa Bahia.
2. Acadêmico da Faculdade de Medicina da Universidade Federal da Bahia. Estudante de Iniciação Científica do Centro de Pesquisas Gonçalo Moniz, FIOCRUZ - BA.
3. Acadêmica da Faculdade de Medicina da Universidade Federal da Bahia.
4. Doutoranda em Patologia pelo Centro de Pesquisas Gonçalo Moniz, FIOCRUZ - BA. Médica Otorrinolaringologista do Serviço de Otorrinolaringologia do Hospital Santa Izabel, Salvador - BA.
5. Doutorando em patologia pelo Centro de Pesquisas Gonçalo Moniz, FIOCRUZ - BA. Médico do Serviço de Imunologia do Hospital Universitário Professor Edgard Santos, Universidade Federal da Bahia, Professor de Imunologia Médica da Faculdade de Medicina da Universidade Federal da Bahia.
Instituição: Serviço de Otorrinolaringologia, Santa Casa de Misericórdia da Bahia - Hospital Santa Izabel. Salvador / BA - Brasil.
Endereço para correspondência:
Nilvano Alves de Andrade
Praça Conselheiro Almeida Couto, 500 - Nazaré
Salvador / BA - Brasil - CEP 040050-410
E-mail: nilvano@gmail.com
Artigo recebido em 18 de maio de 2008.
Artigo aceito em 31 de julho de 2008.